

診断病理学は直接患者に接することないが、患者の病気となっている臓器を形態学的に観察し、腫瘍を中心とした様々な疾患の病理形態学的診断を通じて診療に参加している。腫瘍の悪性度や組織型の診断、進行度の詳細な評価に加えて、分子標的薬に代表される薬物治療においても個々の患者に最も適切な選択を考慮する際に病理組織学的な評価が必須となってきた。このような時代の新しい要求に対しても適切に対応できるよう、人体病理学分野、包括病理学分野と協力し、免疫染色、電子顕微鏡やFISHなどの先端技術を用いて各臓器の高度な専門性に対応した診療を行っている。
具体的には
1.病理診断を通じた診療への参加、
2.病理解剖を通じた医療行為の検証、
3.病理診断医の育成、
4.病理形態学的な新しい診断方法の開発
という4つを目標としている。
本学病理関連部門(人体病理学分野、包括病理学分野、形態情報解析学分野、難研神経病理学分野、歯学部口腔病理学分野)及び臨床各科と連携しながら診療、教育、研究活動を行っている。
1. 微小環境における薬剤耐性機構の探索とその病態生理
2.造血器腫瘍におけるがん遺伝子制御機構の解析
3.病理診断に有用な組織学的診断マーカーの開発
4.悪性中皮腫の臨床病理学的研究
5.IBDの臨床病理学的研究
6.糸球体疾患の臨床病理学的研究
7.膵神経内分泌腫瘍の臨床病理学的研究
8.神経変性疾患の臨床病理学的研究
<骨髄微小環境における薬剤耐性の研究>
従来のCRISPR screening法では、薬剤曝露などの条件下でランダム変異を誘発するCRISPRライブラリーを用いて腫瘍細胞の選択的な生存/死滅を検出することにより、薬剤耐性候補遺伝子が同定されてきました。しかし、「がん微小環境」などの周辺環境からの細胞間相互作用による薬剤耐性の場合、細胞間相互作用による薬剤耐性の責任候補遺伝子の同定は困難でありました。これは、周囲の支持細胞にランダムな変異が誘導されても、支持細胞自身は薬剤下で選択的に生存/死滅することがないためです。そこで、本研究チームでは薬剤耐性を誘導できる支持細胞を分離するシステムを併用し、「間接的CRISPR screening」と名付けました。
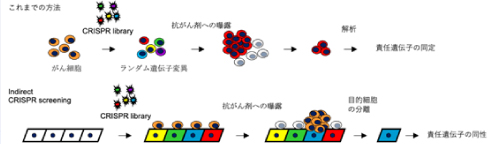
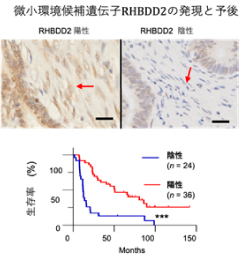
さらなる解析の為、腫瘍細胞の周囲に間質細胞が豊富で治療抵抗性をしめす膵癌検体を用いて解析しました。実際に、候補遺伝子の中でRHBDD2において、癌周囲間質細胞での発現陰性群では陽性群と比較して有意に全生存期間が短縮していることが判明しました(図4)。この結果は、今回の「間接的CRISPR screening」で同定されたRHBDD2が、腫瘍周囲の間質で発現が欠損することにより、抗癌剤の薬剤耐性を誘導し、生存期間が短縮している可能性を示唆しています。
Sugita K et al. Communications Biology 2023:Indirect CRISPR screening with photoconversion revealed key factors of drug resistance with cell-cell interactions
https://www.nature.com/articles/s42003-023-04941-9
肉眼・組織形態学的な方法による疾患の診断・病態の評価を実践する能力を取得することが基本となる。そして病理診断上の問題点や限界点を抽出、その解決に必要な研究技術を取得、問題解決を通じて新たな病理組織学的な診断方法を開発していくことを目標とする。